Propriedades físicas da matéria
As propriedades físicas são propriedades específicas de determinada matéria. São aquelas que podem ser observadas quando há ação mecânica ou do calor (energia térmica). As propriedades que estudaremos são:
Densidade, dureza, ponto de fusão, ponto de ebulição, calor específico, permeabilidade, condutibilidade.
Densidade
É o resultado da divisão entre a quantidade de matéria (massa) e o seu volume ocupado, também é chamada de massa específica.
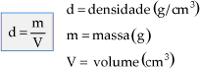
Se pegarmos 10g de algodão e 10g de chumbo, a quantidade de chumbo que teremos que pesar é bem menor que a quantidade. Isso se deve a densidade de cada um que é diferente, o algodão tem a densidade menor, por isso é mais leve e precisa de um volume maior pra completar as 10g em relação ao chumbo.
Vocês saberiam me dizer o por quê de certos objetos flutuam e outros afundam?! Isso está relacionado com a densidade do objeto e do líquido presente. Por exemplo, a água tem densidade de aproximadamente 1 g/cm3, o isopor tem d = 0,03 g/cm3 e o chumbo tem d = 11,3 g/cm3 , como o isopor é menos denso que a água ele irá flutuar e o chumbo que é mais denso irá afundar.
A densidade além de depender do tipo de material do objeto, depende também da temperatura. Um aquecimento, por exemplo, provoca a agitação das moléculas e quando elas se chocam, impulsionam a molécula do lado pra mais longe e assim ocorre dilatação do material (aumento de volume), o que interfere no valor da densidade.
Os gases, tem o volume muito sensível à variação de pressão, então a densidade dependerá também da pressão exercida sobre ele. Portanto, se houver mudanças de estado físico de um gás, ocorrerá também mudança na densidade dele. O fato de a água líquida, por exemplo, possuir uma densidade de 1 g/cm3, e a água sólida (gelo) ter d = 0,92 g/cm3, permite-nos entender o porquê do gelo flutua na água mesmo sendo constituídos da mesma matéria.
Dureza
Representa a resistência que a superfície de um material tem à ação mecânica. Um material é considerado mais duro que o outro quando consegue riscar esse outro deixando um sulco. É medida em graus (0 a 10) o valor 1 corresponde ao mineral menos duro que se conhece, o talco e o valor 10 é a dureza do diamante, o mineral mais duro já visto.
Ponto de fusão
É a temperatura em que uma determinada matéria passa do estado sólido para o líquido e vice-versa em uma determinada pressão. Exemplos:
|
Substância |
Ponto de Fusão (ºC) |
|
Oxigênio Nitrogênio Água Ouro Ferro |
-218,8 -210 0 1064 1538 |
Ponto de ebulição
É a temperatura em que uma determinada matéria passa do estado líquido para o estado gasoso e vice-versa em uma determinada pressão. Exemplos:
|
Substância |
Ponto de Ebulição (ºC) |
|
Oxigênio Nitrogênio Água Ouro Ferro |
-183 -196 100 2856 2861 |
Durante o aquecimento de substâncias puras, quando se atinge o ponto de fusão ou de ebulição, a temperatura da substância deixa de aumentar, mesmo que continue a aquecê-la. Só quando toda a substância tiver sofrido a mudança de estado físico é que a temperatura volta a aumentar. Assim, podemos determinar se uma substância está pura ou não medindo seu ponto de fusão. Se durante a fusão houver variações acima de 1ºC é sinal que sua substância não está pura.
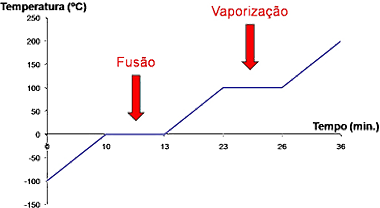
Abaixo temos um gráfico de como varia a temperatura quando aquecemos uma amostra de água pura, desde os -100 ºC até aos 200 ºC. Observe que durante a fusão e vaporização as temperaturas param de subir:
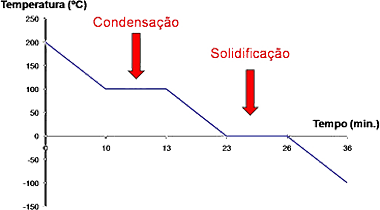
Durante o resfriamento o resfriamento, o gráfico começa na temperatura mais alta até a temperatura mais baixa:
Vamos aproveitar essas propriedades físicas da
matéria e aprender um pouco mais sobre
os estados físicos?!
Uma substância pode ser encontrada no estado físico LÍQUIDO, SÓLIDO OU GASOSO.
Estado gasoso
Nesta fase as partículas da substância estão com maior energia cinética, ou seja, elas estão se movimentando mais, livremente e com maior velocidade colidindo entre si. Essa colisão faz com que as moléculas se afastem e por isso a distância entre as moléculas no estado gasoso é maior que a do estado líquido e do estado sólido sucessivamente.
Um gás qualquer colocado dentro de uma garrafa de 1 litro adquire a forma da garrafa e seu volume será de 1 litro. Assim, dizemos que na fase gasosa possui forma e volume variáveis.
Sabendo que os gases (ao contrário dos líquidos e sólidos) não têm volume fixo, com um aumento de pressão podemos comprimi-los, ou reduzir o seu volume facilmente, pois há mais espaço entre as partículas.
Estado líquido
No estado líquido, a matéria tem forma variável e volume definidos. As partículas estão um pouco mais unidas, não há um arranjo definido. As partículas nos líquidos “deslizam” umas sobre as outras e se movem. Isto é o que proporciona a fluidez no líquido. Todos os líquidos podem fluir, e alguns mais que os outros. Os líquidos com baixa viscosidade oferecem menor resistência para fluir A água, por exemplo, flui com mais facilidade que o óleo. Então a água tem baixa viscosidade e o óleo tem alta viscosidade.
Estado sólido
No estado sólido, o corpo tem forma e volume definidos. A matéria em estado sólido pode se apresentar compacta, em pedaços ou em pó. As partículas que formam a substância possuem a menor energia cinética; elas permanecem praticamente imóveis, unidas por forças de atração e geralmente com um arranjo definido, ou seja, cada partícula se encontra uma posição certa.
O arranjo das moléculas de água, na fase sólida, é o responsável pelo aumento do seu volume. Então, ao se congelar, a água se expande, formando o gelo que é menos denso que a água na fase líquida.
Abaixo
temos uma imagem ilustrativa de como as moléculas estão organizadas em cada estado
físico: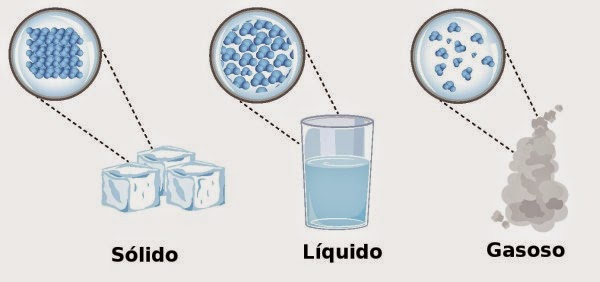
Mudanças no Estado da Matéria
A imagem que está na capa dessa aula representa todas as mudanças de fase da água. Abaixo vai uma outra imagem que tem representa essas mudanças de fases:
Fusão
É a passagem do estado sólido para o líquido. Quando
fornecemos calor a um corpo, suas partículas vibram mais e essa agitação faz
com que ocorra a mudança de estado.
Solidificação
É a passagem do estado líquido para o sólido. Quando se
resfria um corpo, suas moléculas vibram menos e assim se solidificam.
Vaporização
É a passagem do estado líquido para o gasoso. Pode ocorrer
por evaporação (passagem lenta e espontânea estimulada pela temperatura,
ventilação e superfície de evaporação), ebulição (passagem com grande agitação
molecular e a formação de bolhas) e calefação (passagem brusca).
Condensação:
Também chamada liquefação, é a passagem do estado gasoso
para o estado líquido.
Sublimação
É a passagem direta do estado sólido para o gasoso ou
vice-versa.
Agora vamos voltar as outras propriedades físicas da matéria:
Calor específico
O calor específico é a quantidade de calor que deve ser fornecida para que 1 g de substância tenha a sua temperatura elevada em 1°C. Cada substância possui um determinado valor de calor específico, que é geralmente expresso em cal/g.°C.
|
Material |
Calor específico (cal/g.ºC) |
|
Acetona Areia Água Cobre Etanol Ferro Ouro Prata Alumínio |
0,52 0,2 1 0,09 0,59 0,11 0,03 0,05 0,22 |
Quanto maior for o calor específico de uma substância, maior será a quantidade de calor que deverá ser fornecida ou retirada dela para que ocorram variações de temperatura. A água, quando comparada com os outros materiais da tabela, possui o maior calor específico, que corresponde a 1 cal/g.ºC.
Permeabilidade
Específica para o estado sólido, representa a capacidade de corpos materiais em absorver líquidos.
Condutibilidade
Capacidade de uma matéria em transmitir a passagem de uma corrente elétrica
O vídeo do Manual do Mundo tem um experimento que explica bem o que acontece nas mudanças de estados físicos. Neste vídeo, mostra como é que se pode fazer gelo instantâneo. É muito maneiro!!!